
Personalisierte Medizin: Ein Strategiewechsel (Teil 2)
Molekulare Medizin: Nutzen für den Patienten und Nutzen für den Wirkstoff
(Autor: Prof. Dr. Theo Dingermann)
Mag der Nutzen einer stratifizierten Medizin für die Patienten noch einleuchten, scheint eine konsequente Stratifizierung für die Pharmazeutische Industrie, die einen innovativen Wirkstoff entwickelt hat, unattraktiv zu sein, da eine solche Strategie die Zahl der zu behandelnden Patienten strak einschränken wird. Ist das wirklich so? Wie profitieren Patienten und Pharmazeutische Industrie gleichermaßen von einem Strategiewechsel?
Mit dem in den vergangenen Jahren rapide zunehmenden Sicherheitsanspruch in unserer Gesellschaft, sind individuelle Ausschläge hinsichtlich Sicherheit und Wirksamkeit nicht nur für den betroffenen Patienten ärgerlich oder gar gefährlich sein, sie können darüber hinaus auch ein Arzneimittel selbst in Gefahr bringen. Denn wenn sich Meldungen über eine unzureichende Wirksamkeit oder über in der Zahl geringe, aber in der Ausprägung schwere Nebenwirkungen häufen, kann dies heute schnell zum Verlust der Zulassung führen. Es liegt daher im Interesse sowohl der Patienten als auch der pharmazeutischen Industrie, Maßnahmen zu treffen, die derartige Ausschläge hinsichtlich Wirksamkeit und Verträglichkeit eines Arzneimittels vorhersehbar und damit vermeidbar machen.
An zwei Beispielen möchte ich dies erläutern und damit klar machen, wie wichtig es wäre, molekulardiagnostische Maßnahmen zur Einschätzung individueller Wirksamkeit und Verträglichkeit von Arzneimitteln so schnell und so umfassend wie möglich zu implementieren.
Bewährtes Medikament versagt nach Mutation der Tumorzellen
Das erste Beispiel beschreibt eine Situation, die heute bereits umgesetzt werden muss, da sie Wirkstoffe betrifft, bei denen sich eine Änderung der zugelassenen Indikation ergeben hat, nachdem man das zugrunde liegende Prinzip erkannt hat.
Es handelt sich hier um die beiden rekombinanten Antikörper Cetuximab (Erbitux®) und Panitumumab (Vectibix®), die zur Behandlung des Dickdarm- oder Kolon-Karzinoms zugelassen sind. Beide Antikörper blockieren einen Wachstumsfaktorrezeptor – den epidermalen Wachstumsfaktorrezeptor (EGFR) – auf der Oberfläche der Tumorzellen. Indem sie den Rezeptor besetzen, verhindern die Antikörper, dass die Tumorzellen durch einen Wachstumsfaktor zur ständigen Teilung stimuliert werden. Voraussetzung für den Einsatz dieser beiden Antiköper ist natürlich, dass die Tumorzellen tatsächlich diesen Wachstumsfaktorrezeptor aufweisen, was diagnostisch zu überprüfen ist, bevor die Therapieentscheidung getroffen wird.
So plausibel dieses Konzept war und ist, so relativ enttäuschend waren die Therapieerfolge, die man mit diesen Antikörpern erzielen konnte. Das Problem, das Tumoren mit sich bringen, liegt darin, dass sie genetisch stark verändert sind. Und dies umso mehr, je fortgeschrittener der Tumor ist. Eine häufig beobachtete Veränderung, gerade auch bei Kolon-Karzinomen, ist die Aktivierung eines zweiten Signalwegs. Er ähnelt dem, der durch den erwähnten Wachstumsfaktorrezeptor primär aktiviert wird. Dieser zweite Weg gerät außer Kontrolle, wenn ein bestimmtes Gen, das K-Ras-Gen, mutiert. Es nützt dann nichts mehr, den Weg über den Wachstumsfaktorrezeptor mit einem der beiden Antikörper zu blockieren, da die Blockade über den zweiten Weg umgangen [Abbildung 1].
Um diese Hypothese zu überprüfen, testete man die beiden Antikörper an zwei Patientenkollektiven, die beide an Kolon-Karzinomen erkrankt waren. Bei dem einen Kollektiv lag keine Mutation im K-Ras-Gen vor, bei dem anderen wohl. Wie vorhergesagt, erwies sich die Behandlung mit den Antikörpern bei den Patienten ohne die Mutation im K-Ras-Gen als viel effektiver. Die Zulassungsbehörden reagierten schnell und schränkten den Einsatz der Antikörper auf solche Patienten ein, die an einem Kolon-Karzinom ohne ras-Mutation erkrankt sind.
Dies mag auf den ersten Blick eine für die pharmazeutischen Hersteller katastrophale Entwicklung gewesen sein. Auf den zweiten Blick erwies sie sich jedoch wahrscheinlich als Rettung für die exzellenten Wirkstoffe. Die klassische Testung an einem kaum stratifizierten Patientenkollektiv ließ diese Wirkstoffe „schlecht“ aussehen – zumindest in den Augen der Institutionen, die in unserem System Zusatznutzen bewerten und daher über die Erstattungsfähigkeit von Wirkstoffen entscheiden. In Wirklichkeit handelt es sich um hervorragende Wirkstoffe, wenn sie nur an den „richtigen“ Patienten eingesetzt werden. Daher wird eine intelligente Stratifizierung in Zukunft entscheidend sein, um das Potential neuer Wirkstoffe aufzuzeigen und ihnen eine Change in unserem regulierten Markt zu verschaffen.
Wenn die Gene entscheiden, ob ein Medikament wirksam ist
Das erste Beispiel beschrieb eine Situation, in der eine therapierelevante Mutation im Laufe des Lebens des Patienten erworben wurde. Um diese zu finden, muss das Gewebe untersucht werden, in dessen Zellen sich die Mutation einnisten konnte, beispielsweise die Zellen eines Tumors.
Es gibt aber auch therapierelevante Mutationen, die ererbt wurden und daher in allen Zellen vorhanden sind und folglich auch aus allen Zellen zu jedem beliebigen Zeitpunkt im Leben – als nicht erst im Zuge einer Erkrankung – nachweisbar sind. Hier handelt es sich beispielsweise um Mutationen in Genen, die für Proteine kodieren, die ein eingenommenes Arzneimittel chemisch verändern, beispielsweise, um sie für die Ausscheidung vorzubereiten. Eine chemische Veränderung kann aber auch notwendig sein, um ein inaktives Arzneimittel – ein so genanntes Prodrug – im Körper zu aktivieren. Dazu ein Beispiel: Wie man noch gar nicht so lange weiß, ist der alte, zur Behandlung von Brust- und Eierstockkrebs sehr bewährte Wirkstoff Tamoxifen ein Prodrug, also ein Molekül, das erst im Organismus durch verschiedene Vertreter der Gruppe der Cytochrom-P450-Enzyme chemisch in die Wirkform Endoxifen umgewandelt wird [Abbildung 2]. Endoxifen blockiert den Östrogenrezeptor, der, wie der oben erwähnte Wachstumsfaktorrezeptor EGFR beim Kolon-Karzinom Wachstumssignale vermittelt – hier allerdings bei Mamma- und Ovarialkarzinomen.
Tamoxifen ist bei Frauen indiziert, die nach der Operation eines Tumors, dessen Zellen einen Östrogenrezeptor enthalten, „chemopräventiv“ behandelt werden sollen. Die Idee ist, das Wachstum von Resttumorzellen, die nicht operativ entfernt werden konnten, zu blockieren, indem diesen Zellen die Möglichkeit genommen wird, über den Östrogenrezeptor Wachstumsstimuli in den Zellkern zu senden.
Betroffene Frauen nehmen das Medikament über Jahre ein, und die Strategie ist sehr erfolgreich. Allerdings nicht so erfolgreich, wie das theoretisch zu erwarten wäre. Der Grund liegt, wie man jetzt weiß, darin, dass einige Patientinnen nicht der Lage sind, das unwirksame Tamoxifen in die Wirkform Endoxifen umzuwandeln. Große, retrospektive Studien haben gezeigt, dass das für diese Frauen fatal ist. Obwohl ihr Tumor den Östrogenrezeptor enthält, hätten diese Frauen wie Patientinnen behandelt werden müssen, deren Tumor den Östrogenrezeptor nicht exprimiert, da sie die aktive Form des blockierenden Wirkstoffs nicht generieren können. Dies belegen Studien an Biopsiematerial bereits verstorbener Patientinnen erschreckend deutlich [Abbildung 3]. Auf Basis dieser Daten empfiehlt zwischenzeitlich die amerikanische Zulassungsbehörde FDA (Food and Drug Administration) die genetische Testung von Patientinnen, bevor eine Entscheidung zum Einsatz von Tamoxifen getroffen wird. In Europa ist man hier noch deutlich zurückhaltender.
Abbildung 1 A
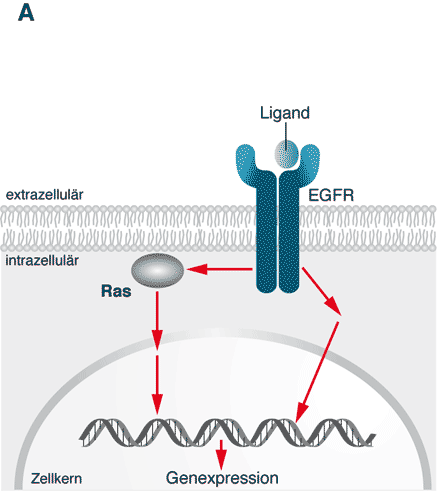
Abb. 1 A. Das ungebremste Wachstum einer Dickdarm-Tumorzelle wird unter anderem dadurch gesteuert, dass ein Wachstumsfaktor (Ligand) an einen epidermalen Wachstumsfaktor-Rezeptor (EGFR) bindet, der in der Membran der Tumorzelle steckt. Dieser Komplex aus Ligand und EGFR aktiviert mehrere Signalkaskaden, die letztlich im Zellkern münden und durch Aktivierung der Genexpression die Zelle so programmieren, dass sie sich ungehemmt teilt.
Abbildung 1 B
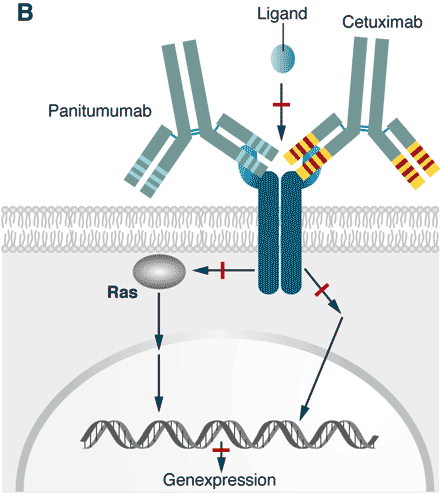
Abb. 1 B. Das in [A] beschriebene fatale Geschehen kann unterbrochen werden, indem man Antikörper einsetzt, die an der Wachstumsfaktor-Rezeptor (EGFR) binden und so verhindern, dass der Ligand binden kann. Das ist nicht nur plausibel, sondern das funktioniert tatsächlich auch, so dass der Tumor sein Wachstum einstellt. Zwei solcher Antikörper sind heute als Medikamente zugelassen.
Abbildung 1 C
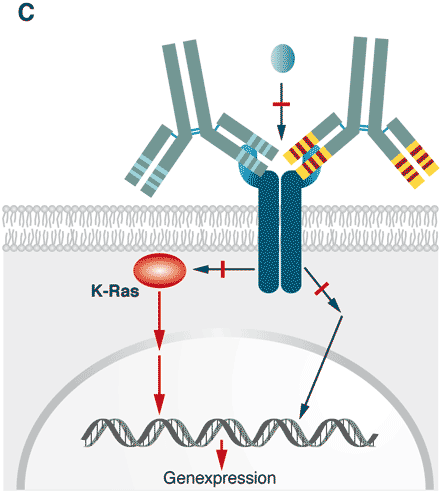
Abb. 1 C. Werden die Tumoren zu spät erkannt, können auch Komponenten der Signaltransduktionskaskade sich genetisch so verändern (mutieren), dass sie die Kaskade unabhängig von dem Liganden/Rezeptor-Komplex aktivieren. In diesem Fall haben die Antikörper ihre Wirksamkeit verloren und können das Wachstum nicht mehr stoppen.
Abbildung 2
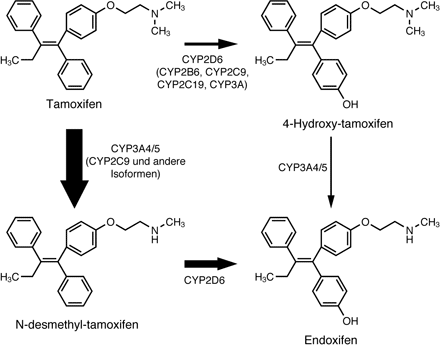
Abb. 2 Tamoxifen ist, wie man heute weiß, ein Prodrug. Es wird über zwei verschiedene Zwischenstufen zu dem eigentlichen Wirkstoff Endoxifen aktiviert. Entscheidend ist dabei das Cytochrom-Isoenzym CYP2D6. Frauen, die aufgrund ererbter Mutationen kein funktionelles CYP2D6 exprimieren können, werden selbst bei täglicher Einnahme von Tamoxifen praktisch nicht behandelt – mit fatalen Konsequenzen (siehe Abb. 3).
Abbildung 3
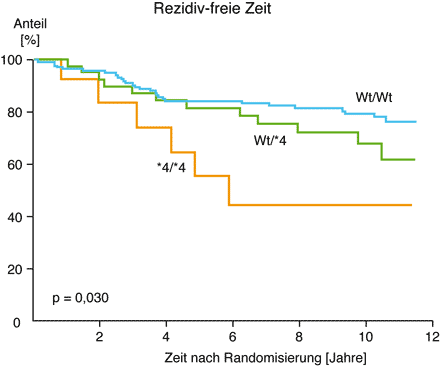
Abb. 3 Kaplan-Meyer Kurve zur Analyse der Überlebenszeit von Patientinnen, die im Rahmen einer Chemo-Prophylaxe nach Resektion eines Rezeptor-positiven Mamma-Karzinoms mit Tamoxifen behandelt wurden. Hier die rezidiv-freie Zeit von Patientinnen, die zwei (Wt/Wt) Kopien, eine (Wt/*4) beziehungsweise keine (*4/*4) intakte Kopie (Wt = Wildtyp) des CYP2D6-Gens aufweisen.





