
Personalisierte Medizin: Ein Strategiewechsel (Teil 1)
Gendiagnostik verbessert die Therapieentscheidung
(Autor: Prof. Dr. Theo Dingermann)
Dem aufmerksamen Beobachter von Gesundheitsthemen wird in jüngster Zeit überproportional häufig der Begriff „Personalisierte Medizin“ begegnet sein. Doch was genau steht dahinter?
In der Tat mag es befremdlich anmuten, dass in der heutigen Schulmedizin kaum „personalisiert“ behandelt werden soll. Jedoch ist das tatsächlich der Fall. Denn bei genauem Hinsehen werden in erster Linie Krankheiten und erst in zweiter Linie kranke Patienten behandelt. Bekanntlich sprechen wir von der Behandlung eines Hochdrucks, des Altersdiabetes, eines Brusttumors. Der individuelle Patient spielt dabei tatsächlich eine eher untergeordnete Rolle. Das ist alles andere als ein Vorwurf an die verantwortlichen Akteure. Bisher gab es nämlich kaum Möglichkeiten, den Patienten so in eine Therapieentscheidung mit einzubinden, wie das eigentlich nötig wäre. Denn schließlich gleicht kein Mensch dem anderen. Und bei genauem Hinsehen gibt es auch kaum identische Krankheitsbilder, auch wenn der Name einer Krankheit das suggerieren mag.
Aus diesem Dilemma heraus werden Arzneimittel hinsichtlich ihrer Wirksamkeit und Verträglichkeit statistisch für eine mehr oder weniger große Testpopulation evaluiert. So wird der Wirkstoff zunächst in unterschiedlichsten biochemisch-pharmakologischen Modellen im Reagenzglas oder an einem isolierten Tierorgan, dann in verschiedenen Tiermodellen und schließlich an Probanden und Patienten getestet. Dieses gestufte Vorgehen ermöglicht zuverlässige Aussagen zur generellen Wirksamkeit und Verträglichkeit des Arzneimittels, und nur wenn eine Nutzen-/Risikoabwägung deutlich zu Gunsten der Nutzenseite ausfällt, wird dem Arzneimittel ein Marktzugang über eine Zulassung durch internationale oder nationale Behörden gewährt.
Ausreißer aus der Statistik können katastrophal sein. Allerdings haben diese Aussagen für den Einzelnen eine gewisse Unschärfe, da sie in Form einer mehr oder weniger ausladenden Gauß’schen Verteilung anfallen [Abbildung 1]. Daran hat man sich gewöhnt, weil es hierzu keine Alternative gab. Wählt man allerdings die Testpopulation groß genug, so beobachtet man teils radikale „Ausreißer“, was für die Betroffenen – und für das Medikament – katastrophal sein kann. Ausschläge in Richtung „Unwirksamkeit“ sind ebenso möglich, wie Ausschläge in Richtung einer individuellen Überdosierung bei prinzipiell korrekter Anwendung, was sich für die Betroffenen in Unverträglichkeit bis hin zu einer relevanten Toxizität äußert. Aber wie soll ein Arzt wissen, ob ein Patient, der ein Medikament erhalten soll, das nach einer statistischen Bewertung den meisten, aber keineswegs allen hilft, die an einer bestimmten Krankheit leiden, tatsächlich von dem Medikament profitiert und dieses Medikament auch gut verträgt?
Die Ursachen solcher individueller Abweichungen von der Norm sind Unterschiede in der genetischen Ausstattung der Menschen [Abbildung 2]. Um diese erkennen und deuten zu können, muss der Arzt genetische Parameter bei einer Interventionsentscheidung mit in Betracht ziehen. Und das ist heute möglich. Diese relativ neuen Verfahren werden als „molekulare Diagnostik“ bezeichnet. Sie bilden die Basis für eine personalisierte – genauer gesagt stratifiziere – Medizin mit dem Ziel, eine Gruppe von Patienten, die alle an der gleichen Krankheit leiden, in mindestens drei Untergruppen aufzuteilen: Eine erste Gruppe von Patienten, die tatsächlich von dem Medikament profitieren, eine zweite Patientengruppe, deren Mitglieder aufgrund genetischer Vorgaben von dem Medikament nicht profitieren kann, und eine dritte Gruppe, deren Mitglieder bei Gabe des Medikaments deutliche Nebenwirkungen erfahren. Die Konsequenzen eines solchen Vorgehens bei einer Interventionsentscheidung, werden einem Paradigmenwechsel gleichkommen, wenn das technische Potential tatsächlich ausgeschöpft wird. Wir werden in absehbarer Zeit einen Wandel erleben; weg von der Behandlung einer Krankheit und hin zur Behandlung eines Patienten mit einer ganz bestimmten genetischen Ausstattung. Klug eingesetzt, wird dieser Wandel den medizinischen Fortschritt skalierbar machen, dahingehend, dass nicht mehr gefragt werden muss, „was können wir uns bei begrenzten Ressourcen leisten“, sondern „was nutzt tatsächlich dem individuellen Patienten“. Wir werden auf Basis genetischer Biomarker Patienten Wirkstoffe vorenthalten, die bei ihnen nicht wirken können, und wir können eine statistisch ermittelte Dosisempfehlung für einen Patienten (in aller Regel nach unten) korrigieren, wenn genetische Marker andeuten, dass der Wirkstoff bei dem individuellen Patienten verzögert ausgeschieden wird. Dadurch ersparen wir dem Patienten nicht nur eine unwirksame und/oder unverträgliche Behandlung, sondern wir können auch Effizienzreserven heben, die das Gesundheitssystem so dringend braucht.
Systematische Untersuchungen dokumentieren eine kaum glaubhafte Zahl an Non- oder Teilrespondern, die nur „verzögert“ wirksam behandelt werden, nachdem empirisch die Unwirksamkeit einer Intervention festgestellt wurde [Abbildung 3]. An diesen Patienten wurden auch Mittel verausgabt, die man hätte sparen oder effizienter ausgeben können.
Die neuen Möglichkeiten der Stratifizierung auf Basis molekulargenetischer Diagnostik werden uns in die Lage versetzen, Arzneimittel deutlich effizienter einzusetzen. Davon profitieren Patienten wie das System gleichermaßen [Abbildung 4].
Abbildung 1
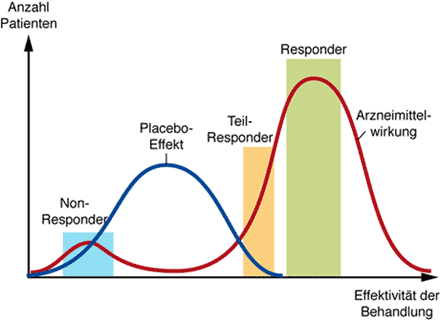
Abb. 1 Beispiel für eine Wirkverteilung in einer großen Population von Probanden oder Patienten.
Beim Testen eines Wirkstoffs erhält man keine Ja/Nein-Antwort, sondern eine Wirkverteilung in Form mindestens zweier Glockenkurven, von denen die eine die „Responder“ umfasst (diejenigen, bei denen das Arzneimittel wirkt), und die kleinere die „Non-Responder“ (diejenigen, bei denen das Arzneimittel nicht wirkt). Innerhalb der Gruppe der Responder kann man in der linken Flanke eine weitere Teilgruppe definieren, die nur partiell auf das Arzneimittel anspricht. Wird in einer klinischen Studie eine Placebo-Gruppe mitgeführt (Patienten, die ein Scheinmedikament bekommen, ohne dass sie darüber informiert werden), so kann aufgrund des Placeboeffekts eine Teilgruppe durchaus in den Wirkbereich des Medikamentes fallen. Die Mehrzahl dieser Patienten wird allerdings von der Behandlung nicht profitieren. (Abbildung Dr. Ilse Zündorf)
Abbildung 2
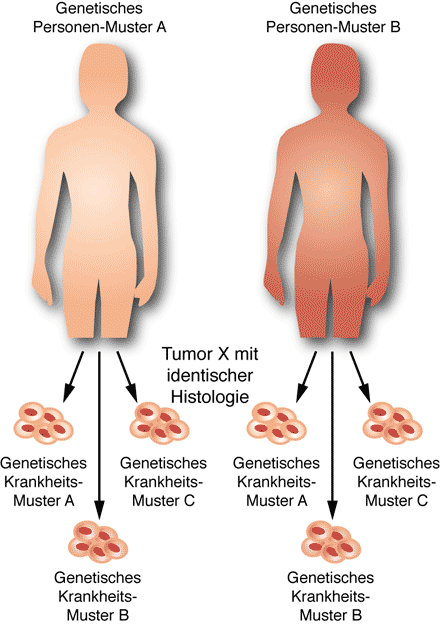
Abb. 2 Jeder Mensch besitzt ganz individuelle genetische Eigenschaften, die die Wirksamkeit und Verträglichkeit einer Arzneimitteltherapie beeinflussen können. Diese genetischen Personenmuster werden vererbt, sind in allen Zellen identisch vorhanden und können zu einem beliebigen Zeitpunkt im Leben charakterisiert werden, um sie dann für den Fall einer Krankheit in die Therapieentscheidung mit einfließen zu lassen.
Zusätzlich liegen beispielsweise bei einem Tumor genetische Variationen (Mutationen) vor, die die Tumorzellen erworben haben. Auch sie können eine Therapieentscheidung maßgeblich beeinflussen. Sie lassen sich nur in den Tumorzellen nachweisen.
Abbildung 3
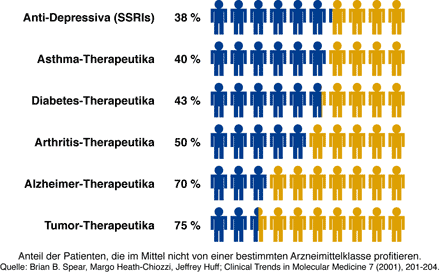
Abb. 3 Der mittlere Anteil von Respondern (blau) und Non-Respondern (gelb) für Wirkstoffe in unterschiedlichen Indikationsgebieten.
Abbildung 4
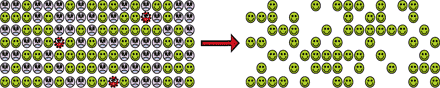
Abb. 4 Behandlung von Krankheiten (links) vs. Behandlung kranker Patienten, die tatsächlich von der Intervention profitieren und diese auch gut vertragen. Konsequent eingesetzt besitzt die molekulare Diagnostik, auf der diese Form der Stratifizierung beruht, ein unglaubliches Potential, Effizienzreserven zu mobilisieren.





